الدماغ والشهية
ما يعلمه الجميع هو أن الاضطرابات النفسانية تؤثر على شهية الإنسان للطعام، وليس من المبالغة القول بأن لا يوجد تقييم طبنفساني لأي مراجع دون الاستفسار عن الشهية والوزن. الهدف النهائي للأكل هو الحصول على طاقة كافية من أجل البقاء على قيد الحياة وفي نفس الوقت تخزينها لاستعمالها وقت الحاجة. على ضوء ذلك يمكن الاستنتاج بأن هناك حوافز عصبية تدافع عن الجسم ضد الجوع وفي الأساس مثل هذه الحوافز في غاية القوة داخل الدماغ.
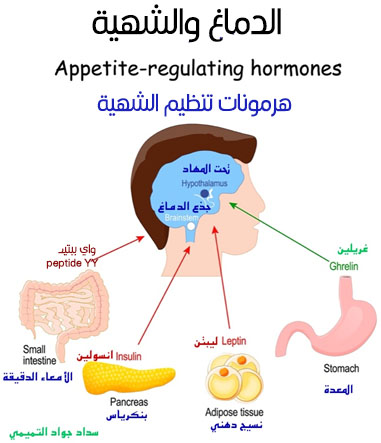
كذلك نعلم الآن بأن هناك هرمونات مصدرها الأنسجة الدهنية داخل الجسم تتفاعل مع الدوائر العصبية داخل الدماغ عبر مستقبلات وقنوات أيونية. يستهدف علاج الاضطرابات النفسانية بالعقاقير ناقلات عصبية كيمائية وفي مقدمتها سيروتونين، دوبامين، ونورادرينالين، وهذا بدوره يؤثر على الشهية والوزن. هذه الناقلات العصبية الكيمائية تتفاعل مع منطقة تحت المهاد والتي هي مصدر إنتاج وإفراز العديد من المواد الكيمائية التي تؤثر على الشهية والوزن.
الشهية
الوظيفة الأساسية لمنطقة تحت المهاد1 Hypothalamus هو الحفاظ على التوازن الفسيولوجي داخل الجسم عبر دمج أحاسيس خارجية وداخلية وبعدها يتم تعديل إفرازات الغدة النخامية، تحفيز الجهاز العصبي الذاتي Autonomic Nervous System، وسلوك الإنسان نفسه من أجل السيطرة على نقاط الضبط الفسيولوجية داخل الجسم. دوائر الشهية في منطقة تحت المهاد تستقبل أحاسيس من وترسل الإشارات إلى مناطق مختلفة من الدماع يمكن تلخيصها كالآتي:
١ إشارات بيولوجية فطرية.
٢ إشارات بيئية مثل البصر والشم والذوق.
٣ الدافع إلى الأكل أو عدم الأكل.
٤ الشبع.
كذلك هناك المتعة من تناول الطعام وما يعنيه ذلك استهلاك الطعام بما يتجاوز الحاجة إلى الطاقة استجابة لخصائص الطعام. الشعور بالمكافأة عن طريق تناول الطعام يتم تشفيره عبر مسارات أفيونية في حين الرغبة في الطعام يتم التعامل معها عن طريق دوائر دوبامين العصبية داخل الدماغ.
هرمون ليبتن Leptin
آلية هذا الهرمون2 يمكن اختصارها بأنه الهرمون الذي يدافع عن الجوع. تم اكتشاف هرمون ليبتن والآليات الجزيئية التي تنظم الشهية في منتصف التسعينيات. يتم تصنيعه في الأنسجة الدهنية ويتناسب ذلك مع كمية الدهون المخزونة في الجسم. إشارت التجارب المختبرية الأولية في الحيوان بأن وجود عيب وراثي يمنع صناعة الهرمون يؤدي إلى زيادة الأكل والسمنة المفرطة ويتم عكس ذلك مع حقن الدماغ بهذا الهرمون. بعد ذلك تم الكشف عن وجود عيب وراثي يعيق صناعة الهرمون في الأطفال ويؤدي إلى فرط البلع الشديد Hyperphagia وبالتالي السمنة المفرطة.
يتمثل دور ليبتن في علاقته مع النضوب الغذائي فسيولوجيا ولذلك فإن الصيام أو فقدان الوزن يؤدي إلى انخفاض مستوياته وذلك بدوره يؤدي إلى السعي إلى استرجاع الطاقة واستعادة التوازن الفسيولوجي. على ضوء ذلك فإن مستوياته تنخفض بعد حمية شديدة وذلك يؤدي إلى فرط الأكل وزيادة الوزن. ما هو معروف الآن بأن رد الفعل الارتدادي الذي يحصل مع الانقطاع عن الطعام بسبب انخفاض ليبتن يتعطل تدريجياً مع الذين يعانون من القهم العصبي Anorexia Nervosa والاكتئاب الجسيم وذلك يفسر تحديات علاج هذه الاضطرابات.
هرمون ليبتن كذلك عامل مهم في سن البلوغ ويلعب دوره في التطور الجسدي والخصوبة، ولذلك فإن انخفاض مستوياته في هذه المرحلة وبعدها يؤدي إلى انقطاع الطمث وذلك يتم عكسه مع زيادة الوزن أو استعمال ليبتن في التجارب السريرية المختبرية.
في غياب ليبتن تشير دراسات الرنين المغناطيسي بأن صور الطعام تثير الإعجاب جداً مع تنشيط واضح للمخطط البطني الأمامي الوسطي Anteromedial Ventral Striatum (النواة المتكئة Nucleus Accumbens والنواة المذنبة Caudate Nucleus) والمخطط البطني الخلفي الجانبي (بوتامين Putamen والكرة الشاحبة Globus Pallidus). يلعب ليبتن دوره عن طريق تغيير النشاط الكهربائي للخلايا العصبية الناقلة للدوبامين.
تأثيرات ليبتن الفسيولوجية يتم عن طريق دوائر عصبية في منطقة تحت المهاد وكذلك مناطق أخرى مجاورة. مع التغذية يتم إفراز ليبتن الذي يحفز الخلايا العصبية الأولية في النواة المقوسة Arcuate Nucleus في منطقة تحت المهاد، والتي تعبر عن مادة برو-افيوميلانوكورتين Pro-Opiomelanocortin POMC. تعمل الببتيدات المشتقة من POMC على مستقبلات ميلانوكورتين 4 Melanocortin 4 Receptors (MC4R) للتقليل من استهلاك الطاقة وزيادة نفقات الطاقة. كذلك يثبط ليبتن الببتيدات العصبية المضادة لمستقبلات ميلانوكورتين والمعروفة ببيتيدات مرتبطة باكوتي Agouti-Related Peptide AGRP.
الببتيدات المحيطية والشهية
هناك عدة هرمونات3 (ببيتيدات) يتم صنعها وإفرازها محيطيا وتعمل على الدوائر العصبية المركزية للمكافأة مع الطعام. هناك هرمونات يتم إطلاقها مع الشبع مصحوبة بإشارات عصبية عبر العصب القحفي العاشر (العصب المبهم) Vagus Nerve وهي:
١. كوليسستوكاينين Cholecystokinin من المعدة.
٢. ببتيد شبيه بجلوكاجون Glucagon – Like Peptide GLP- 1 من الأمعاء الدقيقة. يتم استهداف مستقبلات هذا الهرمون بالعقاقير الجديدة المستعملة لخفض الوزن وعلاج السكري.
3. ببتيد متعدد مثبط للمعدة من الأمعاء الدقيقة.
٤. إنسولين من البنكرياس.
٥. ببتيد YY من الأمعاء الغليظة.
٦. أوكسيتومودلين Oxytomodulin من الأمعاء الغليظة.
أما الجوع فهو يؤدي إلى إفراز هرمون غريلين Ghrelin من الغدد الصماء المعوية والذي بدوره يحفز الإنسان على تناول الطعام.
العقاقير والشهية
تستهدف العقاقير التي يتم استعمالها في علاج الاضطرابات النفسانية الناقلات العصبية التي تؤثر على الشهية، ولكن حصيلة هذا التأثير على الوزن على المدى البعيد لا يسهل التنبؤ به. مضادات الاكتئاب من نوع مثبطات استرداد سيروتونين الانتقائية Selective Serotonin Reuptake Inhibitors SSRI تستهدف الخلايا الناقلة لسيروتونين ويتم تثبيط الأكل عن طريق تحفيز مستقبلات سيروتونين 5-HT2C التي بدورها تتفاعل مع دوائر ميلانوكورتين. كذلك تزيد هذه العقاقير ومثبطات استرداد نورادرينالين من تحلل الدهونLipolysis وبالتالي انخفاض الوزن. رغم ذلك نتيجة هذه الفعاليات على وزن المستعملين للعقار يختلف من مراجع إلى آخر.
أما عقار ميرتازبين فهو يغلق المستقبلات الذاتية فيل المشبكي المعروفة ب ألفا 2 الأدرينالينية Alpha 2 Adrenergic Receptors وهذا بدوره يزيد من إطلاق نورادرينالين وقبط مستقبلات سيروتونين 5HT2 & 5 HT3 وذلك يزيد الشهية والوزن.
عقار بيوبروبيون Bupropion يمنع إعادة استرداد نورادرينالين ودوبامين ويمكن استخدامه لعلاج إنقاص الوزن. يتم خلط هذا العقار مع عقار نالتركسون Naltrexone المضاد لمستقبلات أفيونية من نوع mu يزيد من نشاط الخلايا العصبية الحاملة ل POMC و يتم استعماله لعلاج البدانة.
مضادات الذهان من الجيل الثاني لها تأثير إضافي على هستامين سيروتونين وكولين وقبط مستقبلات 5HT2 C يؤدي إلى زيادة الشهية والبدانة. هذه المستقبلات موجودة أيضاً في الكبد وتساعد على التعامل مع كلوكوز وقبطها يؤدي إلى إصابة من يستعملها أحياناً بالسكري.
مستقبلات مواد الإدمان المعروفة بـ CB1R فهي تتواجد في منطقة تحت المهاد وتحفيزها يؤدي إلى زيادة الشهية، ولكن محاولة قبط هذه المستقبلات كيمائياً من أجل تقليل الوزن يؤدي إلى اكتئاب شديد وأفكار انتحارية.
مصادر:
1. Waterson MJ, Horvath TL. Neuronal regulation of energy homeostasis: beyond the hypothalamus and feeding. Cell Metab 2015; 22: 962–970.
2. Malik S, Mcglone F, Bedrossian D, Dagher A. Ghrelin modulates brain activity in areas that control appetitive behavior. Cell Metab 2008 7: 400–409.
3. Camilleri M. Peripheral mechanisms in appetite regulation. Food and the Brain: How the brain responds to nutrients 2014; 148(6): 1219-1233.
4. Tondo L, Baldessarini R. Psychotropic medicines: increased appetite rather than weight gain. The Lancet psychiatry 2022; 9(2): e8.
واقرأ أيضا:
الجوع والشهية ومعاملُ الشبع / الهرمونات والشهية والوزن / عقاقير تثبيط الشهية (أدوية الرجيم)


